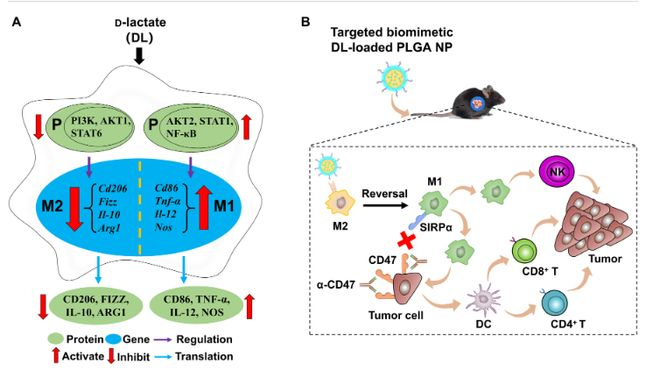
肝癌是世界常见的恶性肿瘤,其发病及死亡人数每年达近90万人和80万人,且呈逐年上升的趋势。免疫疗法为不同的癌症提供了巨大的希望。然而,肝脏体内平衡机制及病理条件造成了肿瘤微环境(TME)的免疫抑制。M2型肿瘤相关巨噬细胞(TAM)是肿瘤微环境免疫抑制的主要因素之一,通常产生免疫抑制因素(如,转化生长因子-β(TGF-β)和白介素10(IL-10))来支持其他免疫抑制细胞(如,髓源抑制性细胞 (MDSCs)和调节性T细胞亚群(T-reg))。与之相反,M1型TAM则生成免疫刺激性因素(如,IL-1β、IL-12和肿瘤坏死因子α(TNF-α))诱导其他免疫刺激细胞(如,细胞毒性T淋巴细胞(CTL)和自然杀伤细胞(NK))。因此,将TAM从M2极化到M1是逆转免疫抑制TME的有效策略。
根据以上背景,2023年7月19日,吉林大学郭建锋教授团队在Science Advances上发表题为D-lactate modulates M2 tumor-associated macrophages and remodels immunosuppressive tumor microenvironment for hepatocellular carcinoma的论文。该研究发现一种肠道微生物组的小分子代谢物D-lactate (DL)可通过抑制磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B (Akt)通路和激活核因子-κB (NF-κB)通路将TAM从M2调控到M1。另外,该研究还开发了一种靶向肝癌肿瘤微环境M2巨噬细胞的HCC膜包被并连接M2pep的PLGA纳米颗粒(NP),用于将DL输送到HCC内的M2 TAM中。由此产生的纳米制剂(DL@NP-M-M2pep)通过HCC膜相关的归巢功能在肿瘤内积累,并通过M2pep介导的靶向能力将DL转运到M2 TAM,导致M2 TAM转化为M1,并在同种异体移植和致癌诱导的原位HCC小鼠模型中重塑免疫抑制的TME。此外,抗CD47抗体与DL@NP-M-M2pep联合治疗肝癌小鼠实现了癌变诱导的原位肝癌小鼠的长期存活,为肝癌的联合治疗提供了一条很有前景的途径。

研究过程:
最近有报道称,肠道微生物组小分子代谢物 d-乳酸(DL)通过门静脉进入肝脏,增强了 库普弗细胞(肝脏驻留巨噬细胞)促进清除血液中病原体的能力。由于 DL 增强了 库普弗细胞的吞噬功能(M1 巨噬细胞的一个关键特征),我们推测 DL 可使 M2 TAMs 极化为 M1 TAMs,并重塑 HCC 的免疫抑制 TME。在本研究中,DL使TAMs从M2转向M1,这主要是由于抑制了磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)通路和激活了核因子κB(NF-κB)通路。
此外,本研究还开发了一种M2巨噬细胞结合肽(M2pep)靶向HCC膜包被聚乳酸-聚乙二醇(PLGA)纳米颗粒(NP),用于向HCC内的M2 TAMs递送DL。由此产生的纳米制剂(称为 DL@NP-M-M2pep)通过 HCC 膜相关的归巢功能在肿瘤内聚集,并通过 M2pep 介导的靶向能力将 DL 运送到 M2 TAMs,从而分别在异体移植和致癌物诱导的正位 HCC 小鼠模型中将 M2 TAMs 转化为 M1 TAMs,并重塑免疫抑制的 TME。此外,抗CD47抗体与DL@NP-M-M2pep的联合应用可使致癌物诱导的原位HCC小鼠长期存活,为HCC的治疗提供了一种前景广阔的联合方法。
论文文链接://www.science.org/doi/10.1126/sciadv.adg2697